Precyzyjna diagnoza i terapia trudno poddających się leczeniu nowotworów złośliwych
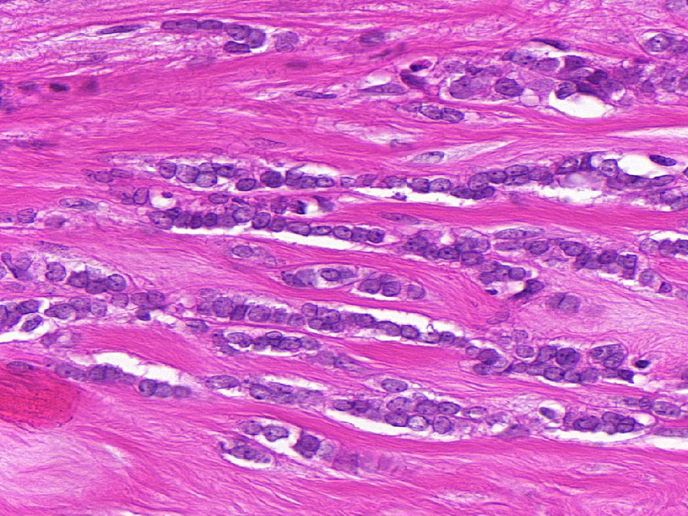
Genotypowanie pod kątem raka pozwala powiązać odpowiedzi na celowane leki przeciwnowotworowe z mutacjami konkretnych genów. Wiele z tych mutacji występuje w elementach sygnalizacyjnych, zwanych kinazami. W przypadku trudnych w leczeniu podtypów inwazyjnego raka zrazikowego (ILC) lub potrójnie ujemnego raka sutka (TN), które stanowią 25% wszystkich nowotworów złośliwych piersi, nie są obecnie dostępne terapie celowane, co powoduje, że rokowania dla chorych są złe. Wspierany przez UE projekt RATHER (Rational Therapy for Breast Cancer: Individualized Treatment for Difficult-to-Treat Breast Cancer Subtypes) polegał na opracowaniu swoistych sygnatur biomarkerów umożliwiających dokładne przewidzenie efektów leczenia u chorych z ILC (z wykorzystaniem testu MammaPrint) lub odpowiedzi na leczenie u chorych z potrójnie ujemnym rakiem sutka (z wykorzystaniem testu BRCAness), jak również odkryciu nowych metod leczenia obu podtypów raka piersi. Wyniki projektu RATHER mają bezpośredni potencjał kliniczny umożliwiający zwiększenie zakresu testu MammaPrint (już zatwierdzonego badania diagnostycznego), by obejmował on podgrupę raka ILC. Projekt przyczynił się również do przeprowadzenia kilku badań klinicznych, jako że opracowano nowe podejścia do diagnostyki i leczenia; obecnie trwają prace nad postępami w kontrolowaniu raka piersi. Medycyna dostosowana do indywidualnych potrzeb Wiele z nowotworów złośliwych powoduje zmiany w kluczowych białkach komórki, zwanych kinazami. Oprócz odgrywania kluczowej roli w mechanizmach fizjologicznych w odniesieniu do nowotworów złośliwych kinazy pełnią również funkcję swego rodzaju wyłączników molekularnych w komórkach, kontrolując ich wzrost i namnażanie się. W ramach projektu RATHER zbadano geny odpowiedzialne za wytwarzanie kinaz, aby dowiedzieć się, czy swoiste zmiany w kodzie genetycznym, czy też raczej zmiany w komórkach rakowych chorych mogą wyjaśnić, dlaczego nowotwór złośliwy tworzy się i rozprzestrzenia. W projekcie RATHER zbadano poziom aktywacji wszystkich kinaz (kinomu) w potrójnie ujemnych guzach sutka, w których nie stwierdza się receptorów estrogenu, progesteronu i HER2 (15% nowotworów złośliwych piersi) i w raku zrazikowym (10% guzów piersi). Konkretnie poddano sekwencjonowaniu 518 genów kodujących kinazy w celu zidentyfikowania mutacji związanych z jednym z dwóch wyżej wymienionych nowotworów złośliwych piersi. Oprócz sekwencjonowania DNA zmiany w kinazach oceniano także na poziomie mRNA i białek, jak również w celu odnalezienia dowodów na istnienie różnic w liczbie kopii. Zmiany badano z wykorzystaniem systemów komputerowych oraz modeli przedklinicznych i laboratoryjnych. Koordynator projektu, prof. William Gallagher, wyjaśnia: „Nasza praca pozwoliła na zidentyfikowanie różnic pomiędzy podtypami raka piersi i opierała się na tym, że niektóre z tych zmian okazują się napędzać rozwój choroby, a nie tylko wywoływać przypadkowe skutki”. Na tyle, na ile było to możliwe, wybierano inhibitory drobnokomórkowe na podstawie ich zdolności do ograniczania wzrostu komórek, w których występują swoiste dla danego podtypu nowotworu zmiany w kinazach. Zespół RATHER pełnił funkcję lidera w wieloośrodkowym badaniu klinicznym fazy Ib/II dotyczącym nowego leku – inhibitora kinaz o nazwie „taselisib”. Wstępne badanie fazy Ib wykazało, że skojarzenie tradycyjnego leczenia działającego na układ hormonalny (tamoksyfen) z nowym inhibitorem kinaz jest dobrze tolerowane. Jak podsumował prof. Gallagher: „Odkrywając zmiany zachodzące w poszczególnych kinazach oraz funkcję zmutowanego białka, a następnie wiążąc to z konkretnym podtypem raka piersi u chorych, poznaliśmy kilka nowych sposobów trafnego przewidywania rokowania i być może także skuteczniejszego leczenia chorych z tym podtypem raka”. RATHER przyczynia się bezpośrednio do zastosowania nowych metod, które nie tylko usprawnią rozpoznanie, ale również zwiększą liczbę dostępnych możliwości leczenia raka piersi – jednej z wiodących przyczyn zgonów kobiet spowodowanych nowotworem złośliwym. Oprócz projektu RATHER podejmowane są inne działania mające na celu opracowanie bardziej zindywidualizowanych metod leczenia raka. Badanie kliniczne fazy II dotyczące nowego inhibitora kinaz jest obecnie prowadzone obok badań uzupełniających.